Ευρωπαϊκή έγκριση σε CAR-T θεραπεία παιδιατρικών και νεαρών ενήλικων ασθενών με οξεία λεμφοβλαστική λευχαιμία Β-κυττάρων
Η έγκριση της Ευρωπαϊκής Επιτροπής βασίζεται στις πρώτες παγκόσμιες μελέτες έγκρισης με CAR-T κύτταρα, στις οποίες συμπεριελήφθησαν ασθενείς από οκτώ ευρωπαϊκές χώρες, καταδεικνύοντας διαρκείς ανταποκρίσεις και σταθερό προφίλ ασφαλείας στην υποτροπιάζουσα/ανθεκτική παιδιατρική Β οξεία λεμφοβλαστική λευχαιμία (ΟΛΛ) και στο υποτροπιάζον/ανθεκτικό διάχυτο από Β μεγάλα κύτταρα λέμφωμα (DLBCL)
Πιο συγκεκριμένα, πρόσφατα, η Ευρωπαϊκή Επιτροπή ενέκρινε το tisagenlecleucel (πρώην CTL019), για τη θεραπεία παιδιατρικών και νεαρών ενήλικων ασθενών ηλικίας έως 25 ετών με οξεία λεμφοβλαστική λευχαιμία Β-κυττάρων (ΟΛΛ), η οποία είναι ανθεκτική, σε υποτροπή μετά τη μεταμόσχευση ή σε δεύτερη ή μεταγενέστερη υποτροπή, και για τη θεραπεία ενήλικων ασθενών με υποτροπιάζον ή ανθεκτικό διάχυτο από μεγάλα Β-κύτταρα λέμφωμα (DLBCL), μετά από δύο ή περισσότερες γραμμές συστηματικής θεραπείας.
Το tisagenlecleucel
Αναπτύχθηκε σε συνεργασία με το Πανεπιστήμιο της Πενσυλβάνια (Penn) και πρόκειται για μια πρωτοποριακή, εφάπαξ θεραπεία που αξιοποιεί τα Τ κύτταρα του ίδιου του ασθενούς για την καταπολέμηση του καρκίνου, ενώ αποτελεί και τη μοναδική θεραπεία με T-λεμφοκύτταρα με χιμαιρικούς αντιγονικούς υποδοχείς (CAR-T) που λαμβάνει ρυθμιστική έγκριση στην ΕΕ για αυτές τις δύο διακριτές κακοήθειες Β κυττάρων. Το tisagenlecleucel ήταν επίσης η πρώτη θεραπεία CAR-T κυττάρων που εγκρίθηκε από τον Οργανισμό Τροφίμων και Φαρμάκων των Η.Π.Α. (FDA).
«Η έγκριση του tisagenlecleucel είναι ένα ορόσημο το οποίο αλλάζει το τοπίο για τους ασθενείς στην Ευρώπη που χρειάζονται νέες θεραπευτικές επιλογές», δήλωσε η Liz Barrett, CEO της Novartis Oncology. «Η Novartis θα συνεχίσει να αναπτύσσει μια παγκόσμια υποδομή για την παροχή θεραπειών CAR-T κυττάρων όπου δεν υπήρχαν στο παρελθόν, παραμένοντας σταθερή στον στόχο της για τον επαναπροσδιορισμό του καρκίνου».
Το tisagenlecleucel, μια διασπορά κυττάρων προς έγχυση σε δόσεις που κυμαίνονται από 1,2 x 10 έως 6 x 10 βιώσιμα CAR-θετικά Τ κύτταρα, είναι ένα ζωντανό φαρμακευτικό προϊόν, το οποίο παρασκευάζεται ξεχωριστά για κάθε ασθενή με επαναπρογραμματισμό των κυττάρων του ανοσοποιητικού συστήματος του ασθενούς. Το tisagenlecleucel είναι η μοναδική εγκεκριμένη θεραπεία CAR-T κυττάρων που περιλαμβάνει συνδιεγερτική περιοχή 4-1BB, η οποία είναι καίρια για την πλήρη ενεργοποίηση της θεραπείας, την ενίσχυση της κυτταρικής ανάπτυξης και τη διατήρηση των κυττάρων που καταπολεμούν το καρκίνο.
Η έγκριση βασίστηκε στην ανασκόπηση των μοναδικών δύο παγκόσμιων κλινικών μελετών CAR-T, τις μελέτες JULIET και ELIANA, στις οποίες συμμετείχαν ασθενείς από οκτώ ευρωπαϊκές χώρες. Σε αυτές τις μελέτες, το tisagenlecleucel επέδειξε υψηλά και με διάρκεια ποσοστά ανταπόκρισης και σταθερό προφίλ ασφάλειας σε δύο δύσκολους στην αντιμετώπιση πληθυσμούς ασθενών. Το 2012 η Novartis και το Πανεπιστήμιο της Πενσυλβάνια προχώρησαν σε διεθνή συνεργασία για την περαιτέρω έρευνα, ανάπτυξη και διάθεση στην αγορά θεραπειών με CAR-T κύτταρα, συμπεριλαμβανομένου του tisagenlecleucel, με στόχο τη διερεύνηση της θεραπείας καρκίνων. Αυτή η συνεργασία μεταξύ της βιομηχανίας και της ακαδημαϊκής κοινότητας ήταν η πρώτη στο είδος της για την έρευνα και την ανάπτυξη θεραπειών CAR-T κυττάρων.
Το tisagenlecleucel χαρακτηρίστηκε ως ορφανό φαρμακευτικό προϊόν και είναι μία από τις πρώτες θεραπείες που έλαβαν έγκριση από την ΕΕ μέσω του PRIME. Το PRIME (PRIority MEdicines) είναι ένα πρόγραμμα του Ευρωπαϊκού Οργανισμού Φαρμάκων (ΕΜΑ) με στόχο την ενίσχυση της υποστήριξης για την ανάπτυξη φαρμάκων που καλύπτουν ανεκπλήρωτες ιατρικές ανάγκες και βοηθούν τους ασθενείς να επωφελούνται όσο το δυνατόν νωρίτερα από θεραπείες οι οποίες μπορούν να βελτιώσουν σημαντικά την ποιότητα ζωής τους.
«Παρέχοντας το tisagenlecleucel σε ασθενείς στην ΕΕ, προάγεται η θεραπευτική πρακτική με πρωτοφανή τρόπο και προσφέρεται μια σωτήρια θεραπεία σε νέους ασθενείς με ΟΛΛ που δεν έχουν αντιμετωπιστεί επιτυχώς με τις υπάρχουσες θεραπείες και τους απομένουν περιορισμένες επιλογές», δήλωσε ο Καθηγητής Peter Bader, Επικεφαλής του Τμήματος Μεταμόσχευσης Αρχέγονων αιμοποιητικών κυττάρων και Ανοσολογίας και Κύριος Ερευνητής της μελέτης ELIANA στο Πανεπιστημιακό Νοσοκομείο Παίδων και Εφήβων της Φρανκφούρτης/Μάιν.
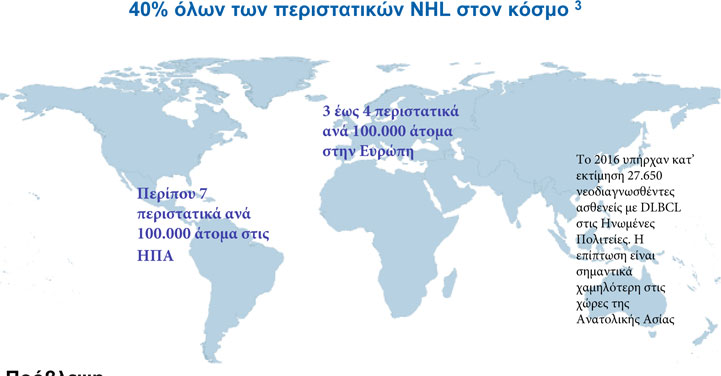
Τόσο η ΟΛΛ Β-κυττάρων όσο και το DLBCL είναι επιθετικές κακοήθειες με σημαντικά θεραπευτικά κενά για τους ασθενείς. Στην Ευρώπη, η ΟΛΛ αντιστοιχεί σε ποσοστό περίπου 80% των περιστατικών λευχαιμίας σε παιδιά και για τους ασθενείς που υποτροπιάζουν μετά από τις συνήθεις θεραπείες οι προοπτικές είναι δυσοίωνες2. Αυτό το χαμηλό ποσοστό επιβίωσης ισχύει παρόλο που οι ασθενείς αναγκάζονται να υποβληθούν σε πολλαπλές θεραπείες, όπως χημειοθεραπεία, ακτινοβολία, στοχευμένη θεραπεία ή μεταμόσχευση αιμοποιητικών κυττάρων, και επιβεβαιώνει περαιτέρω την ανάγκη για νέες θεραπευτικές επιλογές. Το DLBCL είναι η συνηθέστερη μορφή μη-Hodgkin λεμφώματος και αντιστοιχεί σε ποσοστό έως και 40% όλων των περιστατικών παγκοσμίως. Για τους ασθενείς που εμφανίζουν υποτροπή ή δεν ανταποκρίνονται στην αρχική θεραπεία υπάρχουν περιορισμένες θεραπευτικές επιλογές που να παρέχουν ανταποκρίσεις με διάρκεια, ενώ τα ποσοστά επιβίωσης είναι χαμηλά για την πλειονότητα των ασθενών, λόγω της μη καταλληλότητάς τους για αυτόλογη μεταμόσχευση αιμοποιητικών κυττάρων (ASCT) ή λόγω αποτυχίας της χημειοθεραπείας διάσωσης ή της ASCT.
Η Novartis αναμένεται να διαθέσει τη θεραπεία αρχικά για την ένδειξη της παιδιατρικής ΟΛΛ, καθώς θα συνεχίσει να κλιμακώνει τις δυνατότητες παραγωγής της. Επιπλέον, η έναρξη της διαθεσιμότητας του tisagenlecleucel σε κάθε χώρα θα εξαρτηθεί από πολυάριθμους παράγοντες, όπως η συμμετοχή πιστοποιημένων θεραπευτικών κέντρων για τις κατάλληλες ενδείξεις, καθώς και η ολοκλήρωση των διαδικασιών αποζημίωσης. Έχει ήδη δρομολογηθεί η εκπαίδευση σε βασικά πιστοποιημένα θεραπευτικά κέντρα για τη διευκόλυνση της ασφαλούς και απρόσκοπτης χορήγησης στους ασθενείς και η Novartis εξακολουθεί να συνεργάζεται με εθνικές αρχές υγείας και κάλυψης ιατροφαρμακευτικών δαπανών σε ολόκληρη την Ευρώπη για μια δίκαιη τιμολόγηση με βάση την αξία, η οποία θα είναι βιώσιμη για τα εθνικά συστήματα υγειονομικής περίθαλψης.
Καθώς αυτή η καινοτόμος θεραπεία καθίσταται διαθέσιμη σε περισσότερους ασθενείς παγκοσμίως, η Novartis αναζητεί ενεργά ευκαιρίες επέκτασης των μονάδων παραγωγής πέραν των δικών της εγκαταστάσεων στο Morris Plains, New Jersey. Σε αυτό το πλαίσιο εντάσσεται η συμφωνία μας με τη CELLforCURE που εδρεύει στη Γαλλία και είναι ένας από τους πρώτους και μεγαλύτερους συμβαλλόμενους οργανισμούς ανάπτυξης και παραγωγής (CDMOs) που παράγει κυτταρικές και γονιδιακές θεραπείες στην Ευρώπη, η διευρυνόμενη συμμαχία με το Ινστιτούτο Fraunhofer, το οποίο υποστηρίζει επί του παρόντος την παραγωγή του tisagenlecleucel για παγκόσμιες κλινικές μελέτες και μετεγκριτικές εφαρμογές, καθώς και οι προσπάθειες μεταφοράς τεχνολογίας σε έναν οργανισμό CDMO στην Ιαπωνία.
Η μελέτη ELIANA
Η έγκριση του tisagenlecleucel από την Ευρωπαϊκή Επιτροπή για παιδιατρικούς και νεαρούς ενήλικες ασθενείς με υποτροπιάζουσα/ανθεκτική ΟΛΛ Β-κυττάρων βασίζεται στην κλινική μελέτη Φάσης ΙΙ ELIANA, την πρώτη παγκόσμια παιδιατρική μελέτη έγκρισης θεραπείας CAR-T κυττάρων για το tisagenlecleucel σε παιδιά και νεαρούς ενήλικες με υποτροπιάζουσα/ανθεκτική ΟΛΛ Β-κυττάρων. Η ELIANA διεξήχθη σε συνεργασία με το Πανεπιστήμιο της Πενσυλβάνια και το Νοσοκομείο Παίδων της Φιλαδέλφεια, αξιολογώντας το tisagenlecleucel σε ασθενείς σε 25 κέντρα στις Η.Π.Α., τον Καναδά, την Αυστραλία, την Ιαπωνία, την Αυστρία, το Βελγιο, τη Γαλλία, τη Γερμανία, την Ιταλία, τη Νορβηγία και την Ισπανία.
Σε αυτήν την παγκόσμια, πολυκεντρική μελέτη της Novartis, κατά την οποία αξιολογήθηκαν 75 ασθενείς που έλαβαν tisagenlecleucel με τρεις ή περισσότερους μήνες παρακολούθηση, ποσοστό 81% των ασθενών πέτυχαν συνολική ύφεση (95% ΔΕ: 71%-89%), ενώ το 80% των ανταποκρινόμενων ασθενών εξακολουθούσαν να εμφανίζουν ύφεση μετά από 6 μήνες. Το εξήντα τοις εκατό των ασθενών πέτυχαν πλήρη ύφεση (CR) και το 21% των ασθενών πέτυχαν CR με ατελή ανάκαμψη (CRi). Από τους ασθενείς που πέτυχαν ύφεση, σε ποσοστό 100% δεν εντοπίστηκε ελάχιστη υπολειπόμενη νόσος (MRD) στον μυελό των οστών. Η συνολική επιβίωση (OS) ήταν 90% στους έξι μήνες και 76% στους 12 μήνες. Η διάμεση OS ήταν19,1 μήνες (95% ΔΕ: 15,2 - ΝΕ) σε αυτόν τον δύσκολο στην αντιμετώπιση πληθυσμό ασθενών.
Στην ELIANA, το 47% των ασθενών εμφάνισαν σύνδρομο απελευθέρωσης κυτταροκινών (CRS) Βαθμού 3 ή 4. Το CRS αντιμετωπίστηκε ακολουθώντας το παγκόσμιο πρωτόκολλο διαχείρισης CRS σε κλινικά κέντρα που έχουν λάβει την κατάλληλη εκπαίδευση για την ασφαλή χορήγηση και διαχείριση του tisagenlecleucel. Εντός 30 ημερών από την έγχυση του tisagenlecleucel σημειώθηκαν δύο θάνατοι: ένας λόγω εξέλιξης της νόσου με CRS και ένας με αποδρομών CRS από ενδοκρανιακή αιμορραγία. Εντός οκτώ εβδομάδων μετά την έναρξη της θεραπείας, 13% των ασθενών εμφάνισαν νευρολογικά συμβάματα Βαθμού 3 ή 4. Τα συνηθέστερα σοβαρά (Βαθμού 3 ή 4) νευρολογικά συμβάματα ήταν η εγκεφαλοπάθεια ή/και το παραλήρημα. Σοβαρή (Βαθμού 3 ή 4) εμπύρετη ουδετεροπενία και λοιμώξειςπαρατηρήθηκαν στο 36% και το 44% των ασθενών αντίστοιχα.
Η μελέτη JULIET
Η έγκριση του tisagenlecleucel από την Ευρωπαϊκή Επιτροπή για ενήλικους ασθενείς με υποτροπιάζον/ανθεκτικό διάχυτο από Β μεγάλα κύτταρα λέμφωμα (DLBCL) βασίζεται στην κλινική μελέτη Φάσης ΙΙ JULIET, την πρώτη παγκόσμια πολυκεντρική μελέτη έγκρισης για το tisagenlecleucel σε ενήλικους ασθενείς με υποτροπιάζον/ανθεκτικό DLBCL. Η μελέτη JULIET διεξήχθη σε συνεργασία με το Πανεπιστήμιο της Πενσυλβάνια και είναι η μεγαλύτερη μελέτη αξιολόγησης μιας θεραπείας CAR-T κυττάρων για το DLBCL, με τη συμμετοχή ασθενών από 27 κέντρα σε 10 χώρες: στις Η.Π.Α., τον Καναδά, την Αυστραλία, την Ιαπωνία, την Αυστρία, τη Γαλλία, τη Γερμανία, την Ιταλία, τη Νορβηγία και την Ολλανδία. Στη μελέτη JULIET οι ασθενείς έλαβαν την έγχυση είτε ως νοσηλευόμενοι είτε σε εξωτερική βάση.
Σε αυτήν την παγκόσμια, πολυκεντρική μελέτη της Novartis, στους 93 αξιολογήσιμους ασθενείς που παρακολουθήθηκαν για τουλάχιστον τρεις μήνες ή διέκοψαν νωρίτερα, το tisagenlecleucel κατέδειξε συνολικό ποσοστό ανταπόκρισης (ORR) 52% (95% διάστημα εμπιστοσύνης [ΔΕ], 41%-62%), ενώ ποσοστό 40% των ασθενών πέτυχαν πλήρη ανταπόκριση (CR) και ποσοστό 12% πέτυχαν μερική ανταπόκριση (PR). Η ελεύθερη υποτροπής πιθανότητα στους 6 και στους 12 μήνες ήταν 68% και 65% αντίστοιχα, ενώ η διάμεση διάρκεια ανταπόκρισης δεν επετεύχθη έως την ημερομηνία αποκοπής των δεδομένων, υποδηλώνοντας σταθερότητα στην ανταπόκριση. Το ποσοστό συνολικής επιβίωσης (OS) στους 12 μήνες ήταν 49% και η διάμεση OS ήταν 11,7 μήνες σε όλους τους ασθενείς στους οποίους πραγματοποιήθηκε η έγχυση (n=111) (95% ΔΕ, 6,6-ΝΕ).
Στη μελέτη JULIET, το 22% όλων των ασθενών που έλαβαν τη θεραπεία εμφάνισαν σύνδρομο απελευθέρωσης κυτταροκινών (CRS) Βαθμού 3 ή 4 εντός οκτώ εβδομάδων από την έγχυση του tisagenlecleucel, όπως ορίστηκε με την κλίμακα Penn, μια αυστηρή κλίμακα ταξινόμησης του CRS. Το CRS αντιμετωπίστηκε επιτυχώς σε παγκόσμιο επίπεδο παρέχοντας στα κέντρα εκπαίδευση για την εφαρμογή του πρωτοκόλλου αντιμετώπισης του CRS. Δώδεκα τοις εκατό των ασθενών εμφάνισαν νευρολογικά ανεπιθύμητα συμβάντα Βαθμού 3 ή 4, τα οποία αντιμετωπίστηκαν με υποστηρικτική φροντίδα. Με βάση τα εργαστηριακά ευρήματα, αναφέρθηκαν κυτταροπενίες Βαθμού 3 ή 4 διάρκειας άνω των 28 ημερών, οι οποίες περιελάμβαναν θρομβοπενία (41%), λεμφοπενία (28%), ουδετεροπενία (24%), λευκοπενία (21%) και αναιμία (14%), ενώ λοιμώξεις Βαθμού 3 ή 4 και εμπύρετη ουδετεροπενία Βαθμού 3 ή 4 εμφανίστηκαν σε ποσοστό 32% και 15% των ασθενών αντίστοιχα.