Μια νέα εποχή ανατέλλει για τη διαχείριση του Κληρονομικού Αγγειοοιδήματος (ΚΑΟ) στην Ευρώπη, μετά την επίσημη έγκριση κυκλοφορίας που χορήγησε η Ευρωπαϊκή Επιτροπή στο donidalorsen.
Πρόκειται για την πρώτη RNA-στοχευμένη προφυλακτική θεραπεία που λαμβάνει άδεια στην ΕΕ, προσφέροντας μια καινοτόμο λύση για τη μακροχρόνια πρόληψη των επεισοδίων σε ενήλικες και εφήβους άνω των 12 ετών.
Το donidalorsen, αναπτυγμένο από την Ionis Pharmaceuticals και διατιθέμενο στην Ευρώπη από την Otsuka Pharmaceutical, υπόσχεται να αλλάξει τα δεδομένα για τους περίπου 15.000 ασθενείς που ζουν με τη σπάνια αυτή πάθηση στην ευρωπαϊκή ήπειρο.
Τι είναι το Κληρονομικό Αγγειοοίδημα και γιατί η πρόληψη είναι κρίσιμη
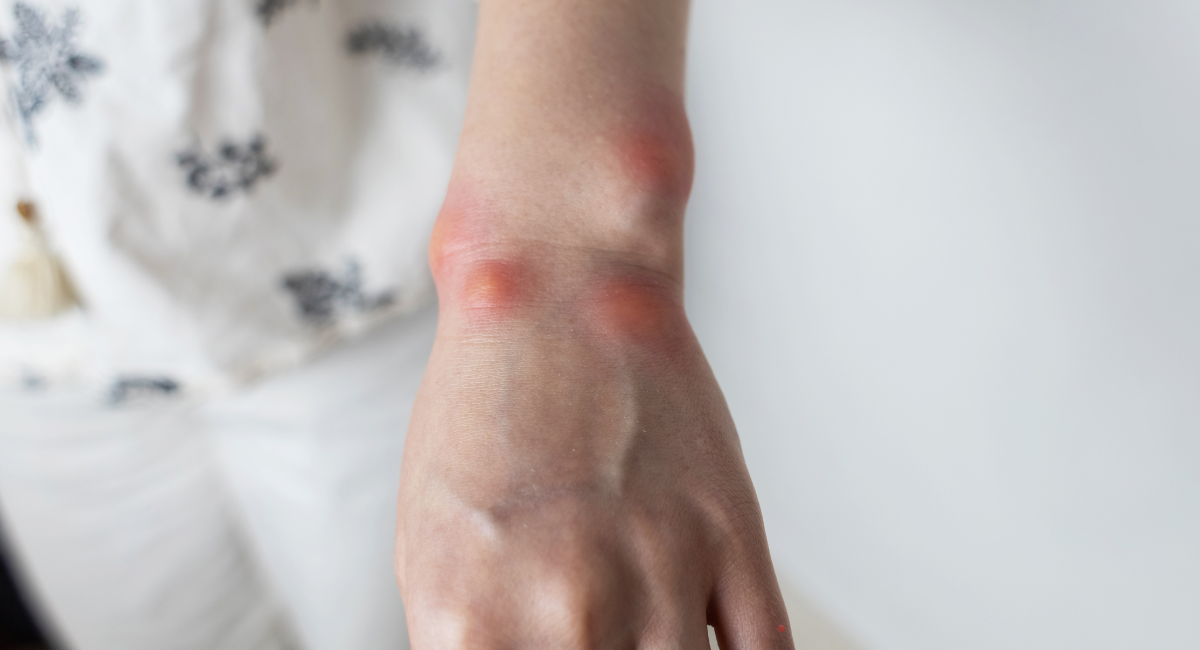
Το ΚΑΟ είναι μια σπάνια γενετική διαταραχή που χαρακτηρίζεται από αιφνίδια και απρόβλεπτα επεισόδια σοβαρού οιδήματος (πρηξίματος) σε διάφορα μέρη του σώματος, όπως:
- Άκρα και πρόσωπο
- Κοιλιακή χώρα (προκαλώντας έντονο πόνο)
- Γεννητικά όργανα
- Λάρυγγας (κατάσταση δυνητικά απειλητική για τη ζωή λόγω ασφυξίας)
Τα συμπτώματα ξεκινούν συνήθως στην παιδική ή εφηβική ηλικία, ενώ η απρόβλεπτη φύση των κρίσεων οδηγεί συχνά τους ασθενείς σε δευτερογενή προβλήματα ψυχικής υγείας, όπως άγχος και κατάθλιψη.
Η τεχνολογία RNA στην υπηρεσία των ασθενών
Το donidalorsen λειτουργεί ως ένα αντινοηματικό ολιγονουκλεοτίδιο (ASO). Η δράση του στοχεύει απευθείας στο ήπαρ, όπου μειώνει την παραγωγή της προκαλλικρεΐνης. Με τον τρόπο αυτό, «κόβει» τη βιολογική αλυσίδα που οδηγεί στην υπερβολική παραγωγή βραδυκινίνης, η οποία είναι η κύρια υπεύθυνη για το οίδημα.
«Η έγκριση αυτή αποτελεί μια ευπρόσδεκτη εξέλιξη», δήλωσε ο Henrik Balle Boysen, Πρόεδρος του παγκόσμιου δικτύου ασθενών HAEi. «Προσφέρει στους ασθενείς μια επιπλέον επιλογή για να προσαρμόσουν τη θεραπεία στις δικές τους ατομικές ανάγκες».
Κλινικά αποτελέσματα: Μείωση των κρίσεων έως και 81%
Η έγκριση βασίστηκε στα εντυπωσιακά δεδομένα της μελέτης Φάσης 3 OASIS-HAE, στην οποία συμμετείχαν 90 ασθενείς. Τα αποτελέσματα έδειξαν:
- 81% μείωση των επεισοδίων ΚΑΟ με χορήγηση κάθε 4 εβδομάδες (Q4W).
- 55% μείωση των επεισοδίων με χορήγηση κάθε 8 εβδομάδες (Q8W).
- 91% των ασθενών πέτυχε καλά ελεγχόμενη νόσο (βάσει του Angioedema Control Test).
- Θεαματική βελτίωση στην ποιότητα ζωής, με σημαντική μείωση στη βαθμολογία του ειδικού ερωτηματολογίου (AE-QoL).
Όσον αφορά την ασφάλεια, το φάρμακο ήταν καλά ανεκτό, με συχνότερες ανεπιθύμητες ενέργειες τις τοπικές αντιδράσεις στο σημείο της ένεσης και την ήπια αύξηση ηπατικών ενζύμων.
Ένα παγκόσμιο ορόσημο για τις σπάνιες παθήσεις
Μετά την έγκριση από τον FDA των ΗΠΑ τον Αύγουστο του 2025, η απόφαση της Ευρωπαϊκής Επιτροπής καθιστά το donidalorsen διαθέσιμο και στα 27 κράτη μέλη της ΕΕ, καθώς και στην Ισλανδία, το Λιχτενστάιν και τη Νορβηγία.
Ο Andy Hodge, Πρόεδρος της Otsuka Pharmaceutical Europe, τόνισε τη δέσμευση της εταιρείας στην κάλυψη ανεκπλήρωτων ιατρικών αναγκών: «Είμαστε υπερήφανοι για αυτό το ορόσημο που αποτελεί καρπό της συνεργασίας μας με την Ionis, φέρνοντας μια νέα ελπίδα σε ασθενείς με σπάνια νοσήματα».